چکیده
غذاهای فوقفرآوری شده (UPFs) به یکی از دستههای غذایی پرمصرف در رژیمهای غذایی مدرن تبدیل شدهاند. با این حال، تأثیر آنها بر سلامت روده نگرانیهای فزایندهای را به همراه داشته است. این مطالعه بررسی میکند که چگونه UPFs بر میکروبیوم روده و سد رودهای تأثیر میگذارند، با تأکید بر دیسبیوز رودهای و افزایش نفوذپذیری روده. UPFs که بهوسیله محتوای بالای افزودنیها و امولسیفایرهای مصنوعی و محتوای پایین فیبر مشخص میشوند، با کاهش تنوع میکروبی، کاهش سطح باکتریهای مفیدی مانند Akkermansia muciniphila و Faecalibacterium prausnitzii و افزایش میکروارگانیسمهای پروالتهابی مرتبط هستند. این تغییرات در جامعه میکروبی موجب التهاب مزمن میشود که با اختلالات مزمن مختلفی از جمله سندرم متابولیک، سندرم روده تحریکپذیر، دیابت نوع 2 و سرطان کولورکتال ارتباط دارد. علاوه بر این، UPFs ممکن است محور روده-مغز را تغییر دهند و ممکن است بر عملکرد شناختی و سلامت روان تأثیر بگذارند. تغییرات رژیمی که شامل فیبر، غذاهای تخمیرشده و پروبیوتیکها باشند میتوانند به کاهش اثرات UPFs کمک کنند. همچنین، نیاز به قوانین سختگیرانهتر برای ممنوعیت UPFs و برچسبگذاری دقیق غذاها وجود دارد. مطالعات بیشتری برای روشن کردن مکانیسمهای ارتباط UPFs با دیسبیوز رودهای و بیماریهای سیستمیک لازم است تا دستورالعملهای غذایی مبتنی بر شواهد را اطلاعرسانی کنند.
2. غذاهای فوقفرآوری شده (UPFs)
2.1. سیستم طبقهبندی NOVA
سیستم طبقهبندی NOVA توسط سازمان خواربار و کشاورزی ملل متحد (FAO) بهعنوان یک ابزار معتبر برای تحقیق در زمینه تغذیه و سیاستگذاری سلامت عمومی شناخته شده است. این سیستم برای طبقهبندی “تمام غذاها بر اساس ماهیت، گستره و هدف فرآیندهای صنعتی که بر آنها انجام میشود” طراحی شده است و به مصرفکنندگان کمک میکند تا غذاها را بر اساس سطح فرآوری و نوع مواد استفاده شده در آنها از یکدیگر تفکیک کنند. در این سیستم، غذاها به چهار گروه تقسیم میشوند:
(i) NOVA1: غذاهای خام یا حداقل فرآوری شده. این غذاها فرآوری حداقلی دارند، مانند حذف قسمتهای غیرقابل خوردن و استفاده از روشهایی مانند خشک کردن، خرد کردن و پاستوریزه کردن، بدون افزودن مواد شیمیایی مانند شکر، نمک یا روغنها. این دسته شامل غلاتی مانند گندم و برنج، حبوبات و محصولات لبنی مانند شیر و ماست بدون شکر اضافی میشود .
(ii) NOVA2: مواد اولیه آشپزی فرآوری شده. این گروه شامل موادی است که از غذاهای NOVA1 بهدست آمدهاند یا از طریق روشهایی مانند پرس، تصفیه و آسیاب شدن فرآوری شدهاند. نمونههایی از این دسته شامل نمک، شکر، عسل، کره و روغنهای گیاهی هستند که بهطور معمول بهتنهایی مصرف نمیشوند. همچنین شامل موادی است که از ترکیب دو مؤلفه NOVA2 بهدست میآیند، مانند کره نمکی و نمک یددار. این مواد برای آشپزی ضروری بوده و طعم و آمادهسازی غذاهای حداقل فرآوری شده را تقویت میکنند .
(iii) NOVA3: غذاهای فرآوری شده. این غذاها با افزودن شکر، روغن، نمک یا دیگر مواد NOVA2 به غذاهای NOVA1 ایجاد میشوند و معمولاً شامل دو یا سه مؤلفه هستند. روشهای نگهداری و آشپزی، از جمله تخمیر غیرالکلی برای مواد غذایی مانند نان و پنیر، برای افزایش دوام و ویژگیهای حسی غذاهای NOVA1 استفاده میشود. این دسته شامل سبزیجات کنسرو شده، حبوبات کنسرو شده، آجیل نمکی، گوشتهای خشکشده، پنیرها و نان تازه پخته شده است .
(iv) NOVA4: غذاهای فوقفرآوری شده (UPFs). این غذاها با فرمولاسیونهای صنعتی شناخته میشوند که شامل پنج یا بیشتر مواد اولیه هستند؛ این محصولات معمولاً شامل افزودنیهایی هستند که بهطور معمول در تهیههای آشپزی یافت نمیشوند، همراه با شکر، روغنها، چربیها، نمک و نگهدارندهها. UPFs معمولاً حاوی مواد NOVA1 بهطور اندک یا هیچ نیستند و هدفشان تقلید یا پنهان کردن ویژگیهای حسی این غذاها است. نمونههایی از این غذاها شامل شیرینکنندههای بدون شکر، روغنهای هیدروژنه، کازئین، آب پنیر، تنقلات بستهبندیشده، نوشیدنیهای شیرین، فستفودها، غذاهای آماده برای مصرف، گوشتهای فرآوری شده، غلات صبحانه شیرینشده، ماست طعمدار، محصولات پختهشده فروشگاهی و چاشنیهای حاوی افزودنیها هستند .
پزشکان و اپیدمیولوژیستها بهطور فزایندهای از طبقهبندی NOVA برای بررسی ارتباطهای بالقوه بین مصرف غذاهای فوقفرآوری شده و مشکلات بهداشتی مختلف مانند اختلالات متابولیک، بیماریهای قلبی عروقی (CVD) و انواع خاصی از سرطانها استفاده میکنند . کشورهای آمریکای لاتین قبلاً NOVA را در دستورالعملهای غذایی خود گنجاندهاند و فرانسه قصد دارد مصرف غذاهای فوقفرآوری شده را با استفاده از دستورالعملهای NOVA تا 20٪ کاهش دهد . این روند نشان میدهد که استفاده از NOVA همچنان گسترش خواهد یافت. با این حال، علیرغم برخی تحقیقات اولیه ، استحکام و عملکرد این سیستم بهطور کامل تعریف نشده است و این امر منجر به ابهام و تفسیرهای متفاوت شده است و باعث اختلافنظرهایی بین کارشناسان شده است . یکی از منابع عدم اطمینان از توصیف UPFs (NOVA4) بهعنوان “فرمولاسیونهای صنعتی، معمولاً با پنج یا بیشتر و اغلب بسیاری از مواد اولیه” است. این ممکن است باعث شده باشد که برخی از محققان غذاهایی با فهرست طولانی مواد اولیه را بهعنوان NOVA4 طبقهبندی کنند، حتی اگر فاقد مواد NOVA4 معمولی مانند “موادی که بهطور معمول در تهیههای آشپزی استفاده نمیشوند” باشند .
2.2. ویژگیهای مشترک غذاهای فوقفرآوری شده
UPFs بهخاطر تنوع محتوای مغذیشان شناخته میشوند، اما معمولاً حاوی مقدار زیادی شکر افزوده هستند که باعث افزایش مصرف کالری بدون ارائه مواد مغذی ضروری میشود. همچنین این غذاها چربیهای ناسالمی مانند چربیهای اشباعشده، چربیهای ترانس و روغنهای هیدروژنه را در بر دارند که میتوانند به سلامت قلب آسیب برسانند. علاوه بر این، UPFs معمولاً حاوی مقادیر بالای سدیم هستند که بهعنوان نگهدارنده و تقویتکننده طعم استفاده میشود و حاوی کربوهیدراتهای تصفیهشده مانند آرد سفید هستند. این غذاها معمولاً فاقد فیبر غذایی هستند که برای سلامت گوارشی و میکروبیوتا حیاتی است. UPFs شامل حداقل غذاهای کامل بوده و اغلب بهشدت فرآوری شدهاند و با افزودنیهای مصنوعی برای تقویت طعم و جذابیت حسی همراه هستند . افزودنیهای رایج در UPFs شامل نگهدارندهها، رنگدهندهها، طعمدهندهها و امولسیفایرها هستند که بهندرت در غذاهای خانگی یافت میشوند. مطالعات اخیر تأثیر منفی افزودنیهای مختلف مصنوعی غذایی را بر میکروبیوتای روده و ارتباط آنها با بیماریهای مزمن از طریق مدولاسیون میکروبی روده نشان دادهاند .
2.3. تغییرات ناشی از فرآوری
UPFs در معرض فرآیندهای صنعتی متعددی برای حفظ غذا و همچنین بهبود طعم، بافت و راحتی قرار میگیرند. درک این تغییرات برای ارزیابی ارزش تغذیهای محصول نهایی و شناسایی پیامدهای بالقوه بهداشتی ضروری است. یکی از رایجترین تکنیکهای فرآوری، واکنش مایار است که برای ایجاد ویژگیهای حسی مانند رنگ، طعم، بو و بافت استفاده میشود. در حالی که محصولات واکنش مایار میتوانند بهعنوان آنتیاکسیدان، باکتریکش، ضدآلرژی و ضدتیرهشونده عمل کنند، میتوانند بهعنوان پرو-اکسیدان و سرطانزا نیز عمل کنند .
1. مقدمه
میکروبیوتای روده انسان یک جامعه پیچیده است که شامل تریلیونها میکروب میشود که در روده ما زندگی میکنند. این میکروبیوتا همزمان با میزبان انسانی تکامل مییابد و یک رابطه همزیستی برقرار میکند و نقش بنیادینی در فرآیندهای فیزیولوژیکی کلیدی ایفا میکند، از جمله بلوغ و تحریک ایمنی، تنظیم متابولیسم مواد مغذی، محافظت در برابر پاتوژنها و حتی عملکرد شناختی . میکروبیوم روده نمایانگر ماده ژنتیکی میکروبیوتای روده است، اگرچه در اینجا از این دو واژه بهطور متناوب استفاده میشود، زیرا میکروبها و ژنومهای آنها هر دو از اهمیت یکسان برخوردارند. هموستاز حساس میکروبیوم روده بهطور فزایندهای توسط عادات غذایی معاصر تحت تأثیر قرار میگیرد و مصرف غذاهای فوقفرآوری شده (UPFs) بهعنوان یک عامل اصلی شناسایی شده است. UPFs، همانطور که توسط سیستم طبقهبندی غذایی NOVA تعریف شدهاند، محصولات صنعتی تولید شدهای هستند که معمولاً بستهبندی شده، انرژیزا و کمارزش از نظر تغذیهای هستند . UPFs شامل موادی هستند که بهطور معمول در آشپزخانههای خانگی یافت نمیشوند، مانند روغنهای هیدروژنه، ایزولههای پروتئینی و افزودنیهای مصنوعی مانند رنگها، امولسیفایرها، تقویتکنندههای طعم و رنگهای مصنوعی. نمونههایی از این غذاها شامل نوشابهها، تنقلات بستهبندیشده، محصولات گوشت فرآوری شده و انواع غذاهای آماده برای مصرف هستند. در دهههای اخیر، UPFs به یک جزء غالب در رژیمهای غذایی در چندین کشور، بهویژه کشورهای صنعتی تبدیل شدهاند . این روند نشاندهنده تغییرات عمیق در سیستمهای غذایی است که توسط صنعتیسازی و جهانیسازی هدایت میشود و در نتیجه دسترسی و جذابیت UPFs به دلیل مقرون بهصرفه بودن، راحتی و طول عمر طولانیشان افزایش یافته است.
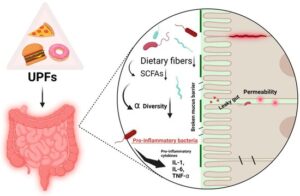
UPFs بهطرق مختلفی بر سلامت روده تأثیر منفی میگذارند ، از جمله کاهش تنوع میکروبیوتای روده، ایجاد تغییرات در جمعیتهای خاص باکتریها و کمک به تخریب سد رودهای، که موجب افزایش نفوذپذیری روده میشود و به شرایطی به نام “روده نشتکننده” (Leaky Gut) منجر میشود، همانطور که در شکل 1 نشان داده شده است . تعادل مختلشده میکروبیوم روده با مشکلات بهداشتی مختلفی از جمله چاقی، دیابت نوع 2 (T2DM)، بیماریهای قلبی عروقی (CVD)، بیماریهای مزمن و حتی برخی اختلالات سلامت روانی مرتبط است . در اینجا، ما شواهد علمی موجود در مورد تأثیر UPFs بر میکروبیوم روده انسان و اکوسیستم روده را بهطور جامع بررسی خواهیم کرد. ابتدا غذاهای فوقفرآوری شده و میکروبیوم روده را توصیف خواهیم کرد و سپس به مکانیسمهای زیرین که از طریق آنها UPFs ترکیب و کارکرد میکروبی را تحت تأثیر قرار میدهند، تغییرات مستند در تنوع میکروبی روده و پیامدهای بهداشتی مرتبط را بررسی خواهیم کرد. علاوه بر این، ما همچنین به پیامدهای این موضوع برای سیاستهای سلامت عمومی و استراتژیهای بالقوه برای کاهش اثرات مضر UPFs بر سلامت روده خواهیم پرداخت.
برای تصویر شکل 1، میتوان به صورت زیر توصیف کرد
2. غذاهای فوقفرآوری شده (UPFs)
2.1. سیستم طبقهبندی NOVA
سیستم طبقهبندی NOVA بهعنوان ابزاری قابل اعتماد توسط سازمان خواربار و کشاورزی ملل متحد برای تحقیقات تغذیهای و توسعه سیاستهای سلامت عمومی شناخته شده است. این سیستم برای طبقهبندی “تمامی غذاها بر اساس ماهیت، گستردگی و اهداف فرآیندهای صنعتی که بر آنها اعمال میشود” طراحی شده است، که به مصرفکنندگان کمک میکند تا غذاها را بر اساس سطح فرآوری و انواع مواد تشکیلدهنده استفادهشده تشخیص دهند. در این سیستم، غذاها به چهار گروه تقسیم میشوند:
(i) NOVA1: غذاهای خام یا حداقل فرآوری شده
این غذاها حداقل فرآوری را تجربه میکنند، مانند حذف قسمتهای غیرقابل خوردن و استفاده از روشهایی مانند خشککردن، خرد کردن و پاستوریزه کردن، بدون افزودن مواد شیمیایی مانند شکر، نمک یا روغنها. این دسته شامل غلاتی مانند گندم و برنج، حبوبات و محصولات لبنی مانند شیر و ماست بدون قند افزوده است.
(ii) NOVA2: مواد اولیه غذایی فرآوری شده
این گروه شامل مواد تشکیلدهندهای است که از غذاهای NOVA1 به دست میآید یا از طریق روشهایی مانند فشار دادن، تصفیه و آسیاب کردن فرآوری میشود. نمونهها شامل نمک، شکر، عسل، کره و روغنهای گیاهی است که معمولاً بهطور جداگانه مصرف نمیشوند. این گروه همچنین شامل محصولاتی است که از ترکیب دو ماده NOVA2 تولید میشوند، مانند کره نمکزده و نمک یددار. این مواد برای پختوپز ضروری هستند و طعم و فرآوری غذاهای حداقل فرآوریشده را تقویت میکنند.
(iii) NOVA3: غذاهای فرآوری شده
این غذاها با افزودن شکر، روغن، نمک یا سایر مواد NOVA2 به غذاهای NOVA1 ساخته میشوند و معمولاً شامل دو یا سه ماده هستند. روشهای نگهداری و پخت، از جمله تخمیر غیرالکلی برای موادی مانند نان و پنیر، برای افزایش دوام و ویژگیهای حسی غذاهای NOVA1 استفاده میشود. این دسته شامل سبزیجات کنسروی، حبوبات کنسروی، آجیل شور، گوشتهای خشکشده، پنیرها و نان تازه پختهشده است.
(iv) NOVA4: غذاهای فوقفرآوری شده (UPFs)
این غذاها با فرمولاسیونهای صنعتی و با پنج یا بیشتر ماده تشکیلدهنده مشخص میشوند؛ این محصولات معمولاً شامل افزودنیهایی هستند که بهطور معمول در فرآوریهای خانگی یافت نمیشوند، بهعلاوه شکر، روغنها، چربیها، نمک و مواد نگهدارنده. UPFs معمولاً حاوی مقادیر کمی یا هیچ ماده NOVA1 نیستند و هدف آنها شبیهسازی یا پنهان کردن ویژگیهای حسی این غذاها است. نمونهها شامل شیرینکنندههای بدون قند، روغنهای هیدروژنه، کازئین، آب پنیر، تنقلات بستهبندیشده، نوشیدنیهای شیرین، فستفود، غذاهای آماده برای مصرف، گوشتهای فرآوریشده، غلات صبحانه شیرینشده، ماست طعمدار، محصولات پختهشده خریداریشده و چاشنیها با افزودنیها هستند.
پزشکان و اپیدمیولوژیستها بهطور فزایندهای از سیستم NOVA برای بررسی ارتباطات احتمالی بین مصرف غذاهای فوقفرآوری شده و مشکلات بهداشتی مختلف مانند اختلالات متابولیک، بیماریهای قلبی عروقی و انواع خاصی از سرطانها استفاده میکنند. کشورهای آمریکای لاتین از پیش NOVA را در دستورالعملهای غذایی خود گنجاندهاند و فرانسه هدف دارد مصرف غذاهای فوقفرآوری شده را به میزان 20% کاهش دهد با استفاده از دستورالعملهای NOVA. این روند نشاندهنده گسترش بیشتر کاربرد NOVA است. با این حال، با وجود برخی تحقیقات قبلی، استحکام و عملکرد این سیستم بهطور کامل تعریف نشده است و باعث ایجاد ابهام و تفسیرهای مختلف شده است و موجب اختلاف نظر بین کارشناسان میشود. یکی از منابع این عدم قطعیت، توصیف UPFs (NOVA4) بهعنوان “فرمولاسیونهای صنعتی، معمولاً با پنج یا بیشتر و معمولاً بسیاری از مواد تشکیلدهنده” است. این ممکن است باعث شده باشد که برخی از محققان غذاهایی با فهرست مواد تشکیلدهنده وسیع را بهعنوان NOVA4 طبقهبندی کنند، حتی اگر آنها فاقد مواد خاص NOVA4 مانند “موادی که معمولاً در تهیههای آشپزی استفاده نمیشوند” باشند.
2.2. ویژگیهای مشترک غذاهای فوقفرآوری شده
UPFs بهخاطر محتوای متنوع مواد مغذی خود شناخته شدهاند، اما معمولاً غنی از شکر افزوده هستند که موجب افزایش دریافت کالری میشود بدون آنکه مواد مغذی ضروری را ارائه دهند. همچنین شامل چربیهای ناسالم مانند چربیهای اشباع، چربیهای ترانس و روغنهای هیدروژنه هستند که میتوانند به سلامت قلب آسیب برسانند. علاوه بر این، UPFs معمولاً حاوی سدیم بالایی هستند که بهعنوان نگهدارنده و تقویتکننده طعم استفاده میشود و شامل کربوهیدراتهای تصفیهشده مانند آرد سفید است. این غذاها معمولاً فاقد فیبر غذایی هستند که برای سلامت دستگاه گوارش و میکروبیوتا ضروری است. UPFs حاوی حداقل مواد غذایی کامل هستند و معمولاً با افزودنیهای مصنوعی برای تقویت طعم و جذابیت حسی فرآوری میشوند. افزودنیهای رایج در UPFs شامل مواد نگهدارنده، رنگها، طعمدهندهها و امولسیفایرها هستند که بهندرت در غذاهای خانگی یافت میشوند. تحقیقات اخیر تأثیر منفی افزودنیهای مصنوعی مختلف در غذاها بر میکروبیوتای روده و ارتباط آنها با بیماریهای مزمن از طریق تغییرات میکروبی روده را مورد بررسی قرار دادهاند.
2.3. تغییرات ناشی از فرآوری
UPFs تحت انواع مختلفی از فرآیندهای صنعتی قرار میگیرند تا غذا را حفظ کنند و همچنین طعم، بافت و راحتی آن را افزایش دهند. درک این تغییرات برای ارزیابی ارزش تغذیهای محصول نهایی و شناسایی پیامدهای بهداشتی احتمالی ضروری است. یکی از متداولترین تکنیکهای فرآوری، واکنش مایار است که برای توسعه ویژگیهای حسی مانند رنگ، طعم، بو و بافت استفاده میشود. در حالی که محصولات واکنش مایار میتوانند بهعنوان آنتیاکسیدانها، باکتریکشها، ضدآلرژیها و ضدقهوهایشدن عمل کنند، ممکن است بهعنوان پرو-اکسیدانها و سرطانزاها نیز عمل کنند. گرمایش در دمای بالا در این فرآیند همچنین میتواند ارزش تغذیهای پروتئینها را کاهش دهد.
اکستروژن یکی دیگر از روشهاست، جایی که مخلوطی از مواد تشکیلدهنده تحت فشار و دماهای بالا از یک دهانه باریک عبور داده میشود. این فرآیند میتواند اکسیداسیون چربی را تحریک کند، که منجر به تشکیل رادیکالهای آزاد و تجزیه اسیدهای چرب غیراشباع میشود. این روش معمولاً برای ایجاد بافتها و اشکال تنقلات، غلات و گوشتهای فرآوریشده استفاده میشود. هیدروژناسیون شامل افزودن مولکولهای هیدروژن به روغنهای مایع برای تبدیل آنها به چربیهای نیمهجامد یا جامد است. این تکنیک که معمولاً در تهیه مارگارین، کرهها و محصولات پختهشده استفاده میشود، چربیهای ترانس را تولید میکند که با اثرات منفی بهداشتی مانند افزایش سطح کلسترول LDL مرتبط هستند.
امولسیفیکاسیون فرآیندی است که با استفاده از امولسیفایرها مخلوطهای پایداری از موادی که بهطور طبیعی با هم ترکیب نمیشوند، مانند روغن و آب، ایجاد میکند. سرخکردن عمیق نیز بهطور معمول برای تهیه تنقلات سرخشده، فستفود و گوشتهای فرآوریشده استفاده میشود. این تکنیک باعث افزایش محتوای روغن در غذا میشود، اکسیداسیون چربی را ترویج میکند و ممکن است مواد شیمیایی مضری مانند آمینهای هتروسیکلیک ایجاد کند. روشهای فریز کردن مانند انجماد و ذوب نیز بهطور گستردهای برای حفظ کیفیت و افزایش عمر مفید غذاها، بهویژه غذا
های منجمد و وعدههای غذایی بستهبندیشده استفاده میشوند.
2.4. الگوهای وعده غذایی و رفتارهای خوردن
مصرف UPFها (غذاهای آماده برای مصرف یا گرمکردنی) معمولاً به زمان و تلاش کمتری نسبت به خوردن غذاهای خام یا حداقل فرآوریشده نیاز دارد. تحقیقات اخیر نشان داده است که مصرف UPFها میتواند با سرعت خوردن، زمانبندی و اختلال در ریتم شبانهروزی مرتبط باشد. در واقع، یک مطالعه اخیر نشان داد که افرادی که دیرتر میخورند بیشتر به مصرف UPFها و کمتری به مصرف غذاهای حداقل فرآوریشده تمایل دارند، که موجب افزایش درک از مکانیسمهای مربوط به ارتباط خوردن دیرهنگام با نتایج منفی متابولیک قلبی میشود. یک متا-تحلیل اخیر همچنین نشان داد که مصرف بالای UPFها با کاهش مدت زمان و کیفیت خواب، بدون توجه به سن، مرتبط است.
3. بررسی میکروبیوم روده انسان و سد روده
3.1. ترکیب و تنوع میکروبیوم روده
میکروبیوم روده انسان یک اکوسیستم پویا از میکروبها است که شامل باکتریها، آرکئاها، ویروسها، قارچها و پروتوزوآها میباشد که در داخل روده زندگی میکنند. این جامعه پیچیده از میکروارگانیسمها نقش مهمی در حفظ سلامت و بروز بیماریهای مختلف ایفا میکند. باکتریها از جمله اجزای رایج و عمیقاً مطالعهشده هستند که به پنج فیل اصلی تقسیم میشوند:
-
Firmicutes، که شامل جنسهایی مانند Lactobacillus، Clostridium، Enterococcus و Ruminococcus است؛
-
Bacteroidetes، که شامل جنسهایی مانند Bacteroides و Prevotella میشود؛
-
Actinobacteria، که عمدتاً توسط Bifidobacteria نمایندگی میشود؛
-
Proteobacteria، که در افراد سالم کمتر رایج هستند، اما این فیل شامل جنسهایی مانند Escherichia، Klebsiella و Enterobacter میشود؛
-
Verrucomicrobia، که عمدتاً توسط Akkermansia muciniphila نمایندگی میشود.
در شرایط فیزیولوژیکی، یک تعادل هموستاتیک بین گونههای باکتریهای مفید مشاهده میشود و Firmicutes و Bacteroidetes فیلهای غالب را تشکیل میدهند. نسبت بین این دو فیل (F:B) تقریباً 1:1 است، اگرچه این نسبت ممکن است بسته به عوامل مختلفی از جمله عادات غذایی، سن، وضعیت سلامتی یا بیماری، و سبک زندگی تغییر کند. برعکس، دیسبایوز به اختلال یا از دست رفتن این تعادل هموستاتیک مفید اشاره دارد، هرچند که تعریف دقیقی از آن هنوز وجود ندارد. علاوه بر این فیلهای غالب، سایر میکروارگانیسمها شامل آرکئای متانزا (مانند Methanobrevibacter spp.)، قارچهای مختلف (مانند Candida spp.، Saccharomyces spp.) و ویروسها (به ویژه باکتریوفاژها)، به تنوع عملکردی روده کمک میکنند. این اجزا به طور پیچیدهای با یکدیگر تعامل دارند و مسیرهای متابولیکی، پاسخهای ایمنی و انسجام ساختاری روده را تنظیم میکنند.
پارامترهای بومشناسی میکروبی مانند α-تنوع و β-تنوع یک روش آسان برای ارزیابی تعادل میکروبیوم روده فراهم میآورند:
-
α-تنوع یک اندازهگیری تاکسونومیک از تنوع گونهها در یک جامعه است که میتواند با معیارهایی مانند غنای (که نشاندهنده تعداد گونههای مشاهدهشده در یک جامعه است) و یکنواختی (که توزیع فراوانی نسبی گونهها را در یک جامعه اندازهگیری میکند) بیان شود. این معیار به طور گستردهای به عنوان شاخصی از یک میکروبیوم روده متعادل و سالم شناخته میشود، زیرا یک میکروبیوم متنوع در برابر اختلالات خارجی مانند عفونتها، استفاده از آنتیبیوتیکها یا تغییرات غذایی مقاومتر است.
-
β-تنوع یک اندازهگیری از ترکیب میکروبی بین نمونهها (نمونههای مختلف یا نمونههایی در زمانهای مختلف) است.
تعامل پیچیده بین گونههای مختلف میکروبی در یک میکروبیوم متنوع همچنین به تولید متابولیتهای مفید مانند اسیدهای چرب با زنجیره کوتاه (SCFAs) و تنظیم سیستم ایمنی میزبان کمک میکند. علاوه بر این، یک میکروبیوم متنوع و سالم ممکن است نقش مهمی در جلوگیری از رشد بیش از حد پاتوژنهای فرصتطلب ایفا کند و به این ترتیب محیطی متعادل و سالم در روده حفظ کند. این عملکردها به طور کلی به حفظ هموستاز روده و ارتقای سلامت کلی بدن کمک میکنند.
3.2. عملکردها و متابولیتهای میکروبیوم روده انسان
میکروبیوم روده نقش حیاتی در فرآیندهای فیزیولوژیکی مختلف ایفا میکند، از جمله عملکردهای متابولیک، تعدیل ایمنی و تنظیم محور روده-مغز. میکروبیوم روده به طور عمده با تجزیه و تخمیر ترکیبات غیرقابل هضم غذایی، به ویژه کربوهیدراتهای پیچیده، مرتبط است و اسیدهای چرب با زنجیره کوتاه کلیدی مانند استات، پروپیونات و بوتیرات را تولید میکند که برای سلامت روده و فراتر از آن ضروری هستند. Firmicutes نقش کلیدی در تخمیر فیبرهای غذایی ایفا میکنند، اما Bacteroidetes و Actinobacteria نیز از طریق متابولیسم کربوهیدراتها و تخریب پلیساکاریدهای پیچیده به سلامت روده کمک میکنند. گونههایی مانند Akkermansia muciniphila، Faecalibacterium prausnitzii، Clostridium butyricum، Prevotella copri و Bacteroides thetaiotaomicron از جمله گونههای اصلی تولیدکننده اسیدهای چرب با زنجیره کوتاه هستند.
3.2.2. تعدیل سیستم ایمنی
میکروبیوم روده تأثیر قابل توجهی بر شکلگیری سیستم ایمنی میزبان دارد و به طور چشمگیری بر پاسخهای ایمنی محلی و سیستمیک تأثیر میگذارد. اکوسیستم میکروبی با میزبان از طریق مسیرهای مختلفی تعامل دارد، از جمله تعامل مستقیم با سلولهای ایمنی و تولید متابولیتهایی که عملکرد ایمنی را تنظیم میکنند. یکی از مسیرهای مهمی که از طریق آن میکروبیوتا ایمنی را شکل میدهد، توسعه و بلوغ بافت لنفوئیدی مرتبط با روده (GALT) است. باکتریهای همزیست تولید پپتیدهای ضد میکروبی را تحریک کرده، توسعه فولیکولهای لنفوئیدی ایزوله را ترویج میدهند و تمایز سلولهای کمککننده T، به ویژه سلولهای Th17 و سلولهای Treg را القا میکنند. این فرآیندها برای حفظ هموستاز روده و جلوگیری از التهاب بیش از حد حیاتی هستند. علاوه بر این، میکروبیوتا بر توسعه و عملکرد سلولهای لنفوئیدی ذاتی (ILCها) تأثیر میگذارد که برای ایمنی موکوسی و ترمیم بافت ضروری هستند. تحقیقات اخیر همچنین نشان دادهاند که برخی از باکتریهای همزیست و پیوند میکروبیوتای مدفوعی (FMT) کارآیی ایمنوتراپی سرطان را از طریق تقویت عملکرد سلولهای ارائهدهنده آنتیژن و تقویت پاسخهای سلولهای T افزایش میدهند. در مقابل، دیسبایوز با اختلالات مختلف ایمنیمدار، از جمله بیماری التهابی روده، بیماریهای خودایمنی و آلرژیها مرتبط بوده است.
3.2.3. اسیدهای صفراوی (BAs)
میکروبیوم روده نقش محوری در بیوتبدیل اسیدهای صفراوی اولیه از طریق مکانیسمهایی مانند دیکانژوگاسیون، د هیدروکسیلاسیون و اپیمریزیشن ایفا میکند که منجر به تولید اسیدهای صفراوی ثانویه میشود. اسیدهای صفراوی به عنوان مولکولهای سیگنالدهنده عمل میکنند، با فعالسازی گیرندههای هستهای مانند گیرنده فارنزوئید X (FXR) و گیرنده اسید صفراوی جفت G پروتئین 1 (TGR5) و فعالیتهای زیستی بسیاری از جمله ویژگیهای ضد التهابی را نشان میدهند. برای مثال، اسیدهای صفراوی شیمیوتاکسی سلولهای نوتروفیل و قطبگیری ماکروفاژها را به نفع فنوتیپ ضد التهابی M2 تغییر میدهند که برای ترمیم بافت و حل التهاب ضروری است و منجر به کاهش سایتوکینهای پیشالتهابی مانند IFNγ و IL-6 میشود. علاوه بر این، اسیدهای صفراوی ترکیب جامعه میکروبی را شکل میدهند و یک حلقه بازخورد ایجاد میکنند که به دلیل فعالیتهای باکتریواستاتیک ذاتی آنها است.
3.2.4. تولید تریمتیلامین (TMA)
یکی از فعالیتهای متابولیک متعدد میکروبیوم روده، تبدیل ترکیبات حاوی گروههای تریمتیلامین مانند کولین، کارنیتین و فسفاتیدیلکولین موجود در غذاهای حیوانی به تریمتیلامین (TMA) است که برای سلامت انسان اهمیت ویژهای دارد. سپس TMA در کبد توسط آنزیمهای فلاوین مونواکسیژناز (FMO3) اکسید شده و به تریمتیلامین-N-اکسید (TMAO) تبدیل میشود که با پاتوژنز بیماریهای قلبی-عروقی (CVD) و سندروم متابولیک (MetS) مرتبط است. تولید TMA عمدتاً به فیلهای Firmicutes و Proteobacteria نسبت داده میشود که در شرایط پیشالتهابی به طور معمول افزایش مییابند. بهویژه، Klebsiella pneumoniae، Clostridium sporogenes، Escherichia fergusonii و Desulfovibrio desulfuricans از جمله گونههای باکتریایی اصلی تولیدکننده TMA هستند.
3.2.5. محور روده-مغز
شواهد روزافزون نشان میدهد که میکروبیوم روده تأثیرات قدرتمندی بر سیستم عصبی مرکزی (CNS) از طریق محور روده-مغز دارد. این سیستم ارتباط دوطرفه شامل مسیرهای هورمونی، عصبی و ایمنی است که دستگاه گوارش را به مغز متصل میکند. یکی از مکانیزمهایی که از طریق آن گونههای میکروبی میتوانند بر میزبان تأثیر بگذارند، تعدیل سنتز انتقالدهندههای عصبی از جمله سروتونین (5-HT) و اسید گاما-آمینوبوتیریک (GABA) است که نقش اساسی در تنظیم خلق و خو، عملکرد شناختی و سلامت روانی دارند. گونههای Lactobacillus و Bifidobacterium به خوبی به دلیل ارتباط با افزایش تولید GABA شناخته شدهاند، در حالی که گونههای Enterococcus در سنتز 5-HT دخیل هستند.
3.2.6. محور روده-گنادی
ارتباط دوطرفه بین میکروبیوم روده و غدد جنسی که به نام “محور روده-گنادی” شناخته میشود، شناسایی شده است. این تعامل شامل مکانیزمهای غدد درونریز، ایمنی و متابولیک است که به طور مستقیم بر عملکرد تولید مثل تأثیر میگذارند. میکروبیوم روده تأثیر زیادی بر متابولیسم هورمونهای جنسی مانند استروژنها و تستوسترون از طریق اقدامات آنزیمی مستقیم و تعدیل غیرمستقیم فیزیولوژی میزبان دارد. این فرآیند شامل فعالیت β-گلوکورونیداز است که برای هیدرولیز متابولیتهای استروژنهای متصل ضروری است. میکروبیوم روده همچنین تأثیر زیادی بر پارامترهای کیفیت اسپرم در مردان از جمله حرکت، غلظت و مورفولوژی دارد. متابولیتهای مفید تولیدشده توسط باکتریهای رودهای، مانند SCFAs، تأثیر مثبت بر سلامت اسپرم دارند.
3.2.7. نقش میکروبیوم روده در دفاع و سلامت متابولیک
میکروبیوم روده از طریق مکانیزمهای مختلفی از جمله جلوگیری رقابتی که در آن میکروارگانیسمهای همزیست، پاتوژنها را از نظر مواد مغذی و محلهای اتصال اپیتلیالی شکست میدهند، از استقرار پاتوژنها دفاع میکند. علاوه بر این، ترکیبات ضد میکروبی مانند باکتریوسینها و اسیدهای صفراوی تولید میکند و همزمان از یکپارچگی سد رودهای برای جلوگیری از انتقال پاتوژنها به سیستم گردش خون حمایت میکند. علاوه بر این، میکروبیوم نقش حیاتی در سنتز ویتامینهای ضروری دارد، به ویژه ویتامین K و برخی ویتامینهای B مانند B12، B6 و فولات که برای فرآیندهای متابولیک مختلف در میزبان ضروری هستند، از جمله مکانیزمهایی مانند لخته شدن خون، سنتز DNA و تولید انرژی سلولی. ارتباط متقابل بین میکروبیوم و میزبان نشاندهنده نقش مهم جمعیتهای میکروبی در حفظ تعادل متابولیک و عملکرد فیزیولوژیکی کلی است.
3.2.8. تولید اسیدهای چرب با زنجیره کوتاه (SCFAs)
اسیدهای چرب با زنجیره کوتاه (SCFAs) منبع انرژی برای سلولهای رودهای (کولونوسیتها) فراهم میکنند و یکپارچگی سد روده را حفظ میکنند. این اسیدها فرآیندهای کلیدی مانند بیان اتصالات سفت، ترشح موزین توسط سلولهای گابلت، تولید ترکیبات ضد میکروبی توسط سلولهای پانث، و همچنین کاهش pH روده را تنظیم میکنند و محیطی نامناسب برای بقاء پاتوژنها ایجاد میکنند.
اسیدهای چرب با زنجیره کوتاه همچنین اشتها را تعدیل کرده و حساسیت به انسولین را از طریق ترشح هورمونهای رودهای مانند پپتید مشابه گلوکاگون-1 (GLP-1)، پپتید YY (PYY) و گیرندههای جفت G پروتئینی (GPR41 و GPR43) بهبود میبخشند. از طریق همین گیرندهها روی سلولهای اندوتلیال عروقی، SCFAs (بهویژه استات و پروپیونات) بر سلامت قلبی-عروقی تأثیر میگذارند، فشار خون را کاهش میدهند، سطوح کلسترول را پایین میآورند و متابولیسم چربی کبدی را تعدیل میکنند. علاوه بر این، SCFAs به عنوان میانجیهای سیستمیک مهم عمل میکنند که متابولیسم، عملکرد ایمنی و هموستاز کلی بدن را تحت تأثیر قرار میدهند. SCFAs تأثیرات عمیقی بر تعدیل ایمنی دارند: بوتیرات عمدتاً از طریق مهار NFkB و بالابردن PPAR γ از طریق مکانیسمهای اپیژنتیکی مانند مهار هیستون داکتیلازها (HDACها) و همچنین تحریک تمایز سلولهای Treg، تولید سایتوکینهای ضد التهابی مانند IL-10، مهار تولید سایتوکینهای پیشالتهابی، و حفظ یکپارچگی سد اپیتلیال اثرات ضد التهابی را ترویج میکند.
3.3. سد روده
سد روده یک ساختار پیچیده و چندلایه است که نقش حیاتی در حفظ سلامت روده و رفاه کلی بدن ایفا میکند. این سد از نظر ساختاری شامل میکروبیوتای روده است که با پاتوژنها رقابت کرده و بر ایمنی تأثیر میگذارد؛ لایه موزین که خواص ضد میکروبی دارد؛ سلولهای اپیتلیال که هم سد فیزیکی و هم ایمنی تشکیل میدهند؛ و بافت لنفوئیدی مرتبط با روده (GALT) که مسئول نظارت بر فعالیت ایمنی است. اتصالات سفت بین سلولهای اپیتلیال، نفوذپذیری پاراسلولی را تنظیم کرده و یکپارچگی سد روده را تضمین میکند. زمانی که این سد مختل شود، میتواند منجر به طیف وسیعی از اختلالات گوارشی و سیستمیک شود، از جمله دیابت نوع 1، آلرژیها و اختلالات عصبی. مطالعات اخیر تأثیر میکروبیوم روده بر عملکرد سد را روشن کردهاند. باکتریهای مفید با آزادسازی SCFAs و سایر متابولیتها که سنتز موزین و تشکیل اتصالات سفت را تقویت میکنند، به یکپارچگی سد کمک میکنند. در مقابل، دیسبایوز میتواند منجر به افزایش نفوذپذیری روده شود که به آن “روده نشتی” گفته میشود و با شرایط بالینی مختلفی مانند بیماری التهابی روده، اختلالات متابولیک و اختلالات عصبی مرتبط است. مصرف UPFs (مواد غذایی فوقفرآوریشده)، استرس و قرار گرفتن در معرض سموم محیطی همه تأثیر منفی بر عملکرد سد روده دارند. درک ارتباطات پیچیده بین این متغیرها و سد روده برای توسعه رویکردهای درمانی هدفمند جهت ترویج سلامت روده و پیشگیری از بیماریها ضروری است.
4. تغییرات ناشی از مصرف UPFs در میکروبیوم روده
شواهد رو به رشدی نشان میدهد که مصرف UPF (مواد غذایی فوقفرآوریشده) میتواند تغییرات قابل توجهی در ترکیب و عملکرد میکروبیوم روده ایجاد کند. UPFs که با محتوای بالای افزودنیها، نگهدارندهها، امولسیفایرها و ترکیبات مصنوعی مشخص میشوند، با اختلال در اکوسیستم میکروبی روده همراه هستند که شامل تکثیر سویههای پیشالتهابی و کاهش تنوع آلفا میکروبی است. در سطح عملکردی، مصرف UPFs با کاهش تولید SCFAs و سایر متابولیتهای محافظ توسط میکروبیوتا مرتبط است. تغییرات مشاهدهشده در ترکیب و عملکرد میکروبی ممکن است تأثیرات دوربردی بر سلامت انسان داشته باشد که شامل التهاب سیستمیک مزمن و استرس اکسیداتیو است که از عوامل اصلی در بروز بسیاری از بیماریهای مزمن مرتبط با مصرف رژیم غذایی UPF هستند.
یک مطالعه اسپانیایی میکروبیوم روده افراد بالغی را که به طور منظم کمتر از 3 وعده از UPFs در روز مصرف میکردند (96 شرکتکننده) و کسانی که بیشتر از 5 وعده از UPFs در روز مصرف میکردند (90 شرکتکننده) ارزیابی کرد. در زنان در گروههای مختلف مصرف UPF، هیچ تغییری در اندازهگیریهای تنوع آلفا مشاهده نشد، در حالی که در مردانی که مقادیر بیشتری از UPFs مصرف کرده بودند، تنوع آلفا کاهش یافت، که نشان میدهد UPFs ممکن است ترکیب میکروبیوتا را به طور متفاوتی در زنان و مردان تحت تأثیر قرار دهد.
افرادی که سطوح بالایی از UPFs مصرف کرده بودند، حضور بیشتری از گروههای باکتریایی بالقوه مضر نسبت به کسانی که مصرف UPF کمتری داشتند، نشان دادند. این باکتریها شامل Granulicatella بودند که با اختلالات متابولیک مرتبط است، همچنین Blautia, Carnobacteriaceae, Bacteroidaceae, Peptostreptococcaceae, Bacteroidia و Bacteroidetes را شامل میشد. در مقابل، مصرفکنندگان UPF زیاد کاهش سطوح Lachnospira و Roseburia را نشان دادند که تولیدکنندگان شناختهشده SCFAs هستند.
امولسیفایرهای رایج مانند CMC (کربوکسیمتیل سلولز)، P80 (پلیسوربات 80)، کاراگینان و گامها معروف به تغییر ترکیب میکروبیوم روده هستند، که محیط میکروبی پیشالتهابی را ترویج میدهند و ممکن است در توسعه اختلالات متابولیکی مانند چاقی و دیابت نوع 2 (T2DM) نقش داشته باشند. این امولسیفایرها شیوع باکتریهای مفید مانند Faecalibacterium prausnitzii و Akkermansia muciniphila که خواص ضد التهابی دارند را کاهش میدهند و به طور منفی بر لایه موزین روده تأثیر میگذارند، که منجر به افزایش نفوذپذیری (“روده نشتی”) و انتقال باکتریها به خون میشود و ممکن است التهاب سیستمیک را تحریک کند.
مطالعات حیوانی بیشتر نشان میدهند که قرار گرفتن در معرض امولسیفایرها باعث کاهش تنوع میکروبی، رشد پاتوژنهای فرصتطلب (مانند Escherichia coli) و تغییر متابولیسم میکروبیوم روده به سمت یک وضعیت پیشالتهابی میشود. P80 آسیبپذیری روده کوچک مدلهای موش را با ترویج دیسبایوز، افزایش فراوانی Gammaproteobacteria و کاهش تنوع آلفا در روده کوچک افزایش میدهد. CMC و P80 بر بیان ژنهای میکروبیوم روده تأثیر میگذارند و منجر به تولید بیشتر مولکولهای التهابی مانند LPS و فلاژلین میشوند که میتوانند سد روده را آسیب ببینند.
قرار گرفتن طولانیمدت در معرض این امولسیفایرها همچنین منجر به کاهش ضخامت لایه موزین میشود که عملکرد حفاظتی آن در برابر پاتوژنها را مختل میکند.
5. تأثیر دیسبایوز ناشی از UPFs بر سلامت انسان
همانطور که قبلاً توضیح داده شد، رژیم غذایی غنی از UPFs باعث عدم تعادل در میکروبیوم روده، اختلال در عملکرد سد روده و افزایش نفوذپذیری روده میشود. این امر اجازه میدهد تا محصولات باکتریایی مضر مانند LPS وارد جریان خون شوند و وضعیت التهاب مزمن و سیستمیک را تحریک کنند. این فرآیند به بروز بیماریهای مزمن غیرواگیر (NCDs) کمک میکند، که شرایط پیچیدهای هستند که با التهاب مزمن و کمدرجه و عدم تعادل میکروبیوم روده مشخص میشوند. این اختلالات شامل شرایط قلبی-متابولیک مانند سندروم متابولیک (MetS)، دیابت نوع 2 (T2DM) و بیماریهای قلبی-عروقی (CVD) است. اختلالات گوارشی مزمن مانند بیماری التهابی روده (IBD) و سندروم روده تحریکپذیر (IBS) نیز جزو این گروه هستند. علاوه بر این، شرایط عصبی و روانی به این فرآیندهای التهابی مرتبط هستند.
5.1. اختلالات قلبی-متابولیک
سندروم متابولیک یک وضعیت پاتوفیزیولوژیک متابولیک است که حداقل سه مورد از پنج معیار زیر را شامل میشود: چاقی مرکزی، فشار خون بالا، هیپرگلیسمی، هیپرتریگلیسریدمیا و کاهش HDL سرمی. این وضعیت با افزایش خطر دیابت نوع 2 (T2DM) و بیماریهای قلبی-عروقی (CVD) مرتبط است.
یک مجموعه جامع از شواهد نشان داده است که چاقی، سندروم متابولیک و عدم تعادل میکروبیوم روده که با کاهش تنوع میکروبی و افزایش ظرفیت استخراج انرژی و تولید ترکیبات مضر مانند TMAO مشخص میشود، با هم مرتبط هستند. تغییرات میکروبیوم ناشی از UPFها با افزایش خطر قلبی-متابولیک مرتبط است: دیابت نوع 2 به نظر میرسد که تحت تأثیر نسبت بالای Firmicutes به Bacteroidetes باشد که با وضعیت پیشالتهابی ارتباط دارد.
علاوه بر این، Akkermansia muciniphila که در افراد مصرفکننده رژیمهای غذایی غنی
از UPFs کمتر یافت میشود، حساسیت به انسولین، سطوح انسولین و کنترل وزن را در افراد چاق و مقاوم به انسولین بهبود میبخشد و در مطالعات حیوانی و انسانی با نوع بدن لاغر مرتبط است.
میکروبیوم همچنین ترکیبات مضر تولید میکند که ممکن است خطر قلبی-عروقی را افزایش دهد: میکروبیوم روده نقشی در متابولیسم چندین آمینواسید ایفا میکند که TMA تولید میکند و سپس به TMAO تبدیل میشود. TMA عمدتاً توسط Firmicutes و Proteobacteria تولید میشود، دو گروه باکتریایی که اغلب در دیسبایوز روده افزایش مییابند. تولید بالای TMAO با افزایش خطر بیماریهای قلبی-عروقی و متابولیک مرتبط است.
برای مثال، یک مطالعه prospective از بیماران تحت آنژیوگرافی کرونری الکتیو نشان داد که سطوح ناشتا TMAO مستقیماً با رویدادهای اصلی بیماری قلبی-عروقی در طول یک دوره پیگیری 3 ساله ارتباط داشت.
5.2. بیماری التهابی روده (IBD)
بیماری التهابی روده، که عمدتاً شامل بیماری کرون (CD) و کولیت اولسراتیو (UC) است، شرایطی هستند که با التهاب مزمن و مکرر غشای مخاطی روده مشخص میشوند. آغاز این بیماریها با عوامل متعددی از جمله پیشزمینه ژنتیکی و قرار گرفتن در معرض شرایط محیطی زیانآور مرتبط است. عدم تعادل در میکروبیوتای روده بیماران مبتلا به IBD نشان داده شده است که به پیشرفت بیماری از طریق مکانیسمهای مختلفی مانند اختلال در عملکرد و افزایش نفوذپذیری سد روده و همچنین افزایش فعالیت سیستم ایمنی کمک میکند. افراد مبتلا به IBD تغییرات کیفی و کمی در میکروبیوتای روده خود نسبت به افراد سالم نشان میدهند: تنوع آلفا در بیماران مبتلا به CD و UC کاهش یافته و با کاهش در گونههای باکتری ضدالتهابی مانند Roseburia hominis, Akkermansia muciniphila, Faecalibacterium prausnitzii, و Eubacterium rectale همراه است. علاوه بر این، گونههای باکتری پیشالتهابی مانند Escherichia coli, Ruminococcus gnavus, و Fusobacterium spp. افزایش یافتهاند. این تغییرات به وضوح با تشدید بیماری و التهاب فعال مرتبط بوده است، در حالی که بیماران مبتلا به IBD آرام نشان دادهاند که پروفایل باکتریاییشان به طور بیشتری شبیه به افراد سالم است. تغییرات در ترکیب باکتریهای رودهای در افراد مبتلا به IBD همچنین مسیرهای متابولیکی کلیدی را تغییر میدهند. به طور خاص، در بیماران مبتلا به IBD، سه مسیر اصلی تحت تأثیر قرار میگیرد: تولید SCFA، متابولیسم اسیدهای صفراوی، و متابولیسم تریپتوفان. این تغییرات به ترویج و حفظ التهاب روده کمک میکند.
5.3. خطر سرطان
همانطور که قبلاً اشاره شد، اختلالات قلبی-متابولیک و IBD با یک وضعیت التهابی مزمن مشخص میشوند که ناشی از دیسبایوز است و نقش حیاتی در مراحل مختلف توسعه سرطان ایفا میکند. با این حال، با توجه به اینکه افزایش شیوع سرطان کولورکتال (CRC) معمولاً با پذیرش سبک زندگی غربی همراه بوده است، رژیم غذایی غربی به عنوان یک عامل اصلی در تأثیرگذاری بر شیوع جهانی CRC شناخته میشود. شواهد فزایندهای نشان میدهد که تفاوتهایی در میکروبیوم مدفوع بین بیماران مبتلا به CRC و افراد سالم وجود دارد. مشابه IBD، دیسبایوز مرتبط با CRC با کاهش تنوع میکروبیوم، از دست دادن باکتریهای ضدالتهابی و افزایش پاتوبایونتها مشخص میشود. یک امضاء باکتریایی خاص در چندین گروه شناسایی شده است که نشاندهنده حساسیت بالای CRC است. Fusobacterium nucleatum, Bacteroides fragilis, و Parvimonas micra از جمله گونههای اصلی هستند که به آدنومها و CRC مرتبطاند. این تاکسا معمولاً در غلظتهای بسیار کم یا غایب در میکروبیوم مدفوع افراد سالم هستند، اما تکثیر آنها ممکن است شروع دیسپلازی و حمله به مخاط را ترویج دهد، همانطور که در بسیاری از مطالعات حیوانی نشان داده شده است. این باکتریهای پیشسرطانی ممکن است اثرات خود را از طریق القای محیط میکروبی التهابی یا از طریق اثرات کارسینوژنیک مستقیم اعمال کنند، تولید متابولیتهای مختلفی مانند سمها یا گونههای اکسیژن فعال که قادر به ایجاد آسیب DNA هستند.
5.4. سلامت روان و عملکرد شناختی
عملکرد شناختی و سلامت روان به شدت با عوامل محیطی مانند رژیم غذایی، سبک زندگی و ترکیب میکروبیوتای روده مرتبط هستند. “محور روده-مغز” این تعامل دوطرفه بین روده و مغز را توصیف میکند که از طریق هومئوستازی، هضم، متابولیتهای میکروبی و سلامت کلی تأثیر میگذارد. به دلیل این ارتباط پیچیده، تغییرات در ترکیب میکروبیوتای روده میتواند منجر به شرایط روانشناختی مانند بیماری آلزایمر (AD)، بیماری پارکینسون (PD) و اختلالات افسردگی شود. به طور کلی، این یافتهها نشان میدهند که مصرف مواد غذایی فوقفرآوریشده (UPFs) میتواند اثرات مضری بر رفاه روانی داشته باشد، ممکن است از طریق مسیرهای التهابی و اختلال در ارتباط روده-مغز.
یک متاآنالیز در سال 2023 که 26 مطالعه مشاهدهای را بررسی کرده و ارتباط بین مصرف UPF و خطر اختلالات سلامت روان را تحلیل کرده است، نشان داد که مصرف UPF با افزایش خطر افسردگی مرتبط است، اما نه اضطراب. علاوه بر این، تحلیل دوز-پاسخ ارتباط خطی مثبت بین مصرف UPF و خطر افسردگی را نشان داد.
علاوه بر این، یک مرور جامع در سال 2024 که 39 متاآنالیز را برای بررسی ارتباط بین UPF و نتایج مختلف سلامت انجام داد، شواهد قوی از ارتباط میان مصرف UPF و افسردگی و اختلالات روانی رایج را کشف کرد. مطالعات نشان میدهند که رژیم غربی (WD) تجمع بتا-آمیلوئید را در حیوانات تسریع کرده و رژیم غذایی میتواند هم پاتولوژی بیماری آلزایمر (AD) را در انسانها و هم در جوندگان ایجاد یا تشدید کند.
پربیوتیکها و پروبیوتیکها به نظر میرسد که شرایط شناختی را در بیماران مبتلا به PD بهبود میدهند، که نشاندهنده نقش رژیم غذایی و میکروبیوتای روده در پاتوژنز بیماری است. علاوه بر این، رژیم غربی به افسردگی از طریق تعاملات میکروگلیا-مغزی و روده-ایمنی کمک میکند. بیماران مبتلا به اختلال افسردگی عمده (MDD) نسبت به افراد سالم کاهش غنای میکروبیوتای روده و تنوع میکروبی را نشان میدهند و تغییراتی در سطوح Bacteroidetes, Firmicutes, Proteobacteria و Actinobacteria مشاهده میشود.
6. استراتژیهایی برای کاهش تأثیرات منفی غذاهای فوقفرآوریشده (UPFs) بر سلامت انسان
غذاهای فوقفرآوریشده (UPFs) تأثیرات منفی قابل توجهی بر سلامت روده دارند که عمدتاً از طریق تغییر ترکیب و عملکرد میکروبیوتای روده اعمال میشود. برای کاهش این تأثیرات، نیاز به رویکردی چندوجهی شامل تغییرات رژیم غذایی، مکملهای هدفمند، و تغییرات سبک زندگی است.
6.1. استراتژیهای رژیمی
کاهش مصرف UPFs یکی از استراتژیهای اصلی برای حفظ سلامت روده است. UPFs معمولاً حاوی مقادیر بالایی از قندهای تصفیهشده، چربیهای ناسالم و افزودنیهای شیمیایی هستند که میتوانند میکروبیوتای روده را مختل کنند. گذار به رژیمی که بر غذاهای کامل و حداقل فرآوریشده متمرکز باشد، مانند میوهها، سبزیجات، غلات کامل، پروتئینهای لاغر و غذاهای تخمیرشده، از تنوع و تابآوری میکروبی حمایت میکند.
توجه خاصی باید به مصرف فیبر رژیمی صورت گیرد. غذاهای پر فیبر، مانند حبوبات، آجیل، دانهها و غلات کامل، زیرساختهایی را برای باکتریهای مفید روده فراهم میکنند و تولید SCFAهایی مانند بوتیرات، استات و پروپیونات را ترویج میدهند. این SCFAها برای حفظ یکپارچگی سد روده و تنظیم التهاب حیاتی هستند. یکی دیگر از استراتژیهای مؤثر، گنجاندن غذاهای تخمیرشده مانند ماست، کفیر، شور، کیمچی و میسو است. این غذاها غنی از پروبیوتیکها (باکتریهای زنده مفید) هستند که میتوانند بر ترکیب میکروبیوتای روده تأثیر مثبت بگذارند. مصرف منظم این غذاها میتواند اثرات دیسبایوتیک UPFs را خنثی کرده و تعادل میکروبی را بازگرداند و سلامت روده را بهبود بخشد.
6.2. مکملهای پروبیوتیک و پریبیوتیک
مکملهای پروبیوتیک به عنوان یک مداخله هدفمند برای کاهش اثرات منفی UPFs بر میکروبیوتای روده شناخته شدهاند. سویههای خاصی از پروبیوتیکها مانند Lactobacillus rhamnosus, Bifidobacterium longum, و Saccharomyces boulardii در کاهش التهاب روده، تقویت ایمنی مخاطی و بازگرداندن تنوع میکروبی مؤثر بودهاند. انتخاب سویه پروبیوتیک باید متناسب با نیازهای فردی و نوع دیسبایوز ناشی از UPFs باشد. پریبیوتیکها، ترکیبات غذایی غیرقابل هضم که رشد باکتریهای مفید را تحریک میکنند، مداخله مهم دیگری هستند. پریبیوتیکهای رایج شامل اینولین، فروکتو-الیگوساکاریدها (FOS) و گالاکتو-الیگوساکاریدها (GOS) هستند. این ترکیبات به طور انتخابی باکتریهای مفید را تغذیه کرده و تکثیر آنها و تولید SCFAها را ارتقاء میدهند. ترکیب پروبیوتیکها با پریبیوتیکها (سینبیوتیکها) ممکن است اثرات همافزایی در معکوس کردن اختلالات میکروبیوتای روده ناشی از UPFs داشته باشد. Akkermansia muciniphila به عنوان یک پروبیوتیک نسل بعدی مطرح شده است به دلیل پتانسیل آن در تقویت عملکرد سد روده، تنظیم پاسخهای ایمنی و بهبود سلامت متابولیک. تجویز روزانه Akkermansia muciniphila در مدل موشی که به مدت 9 هفته در معرض CMC و P80 قرار داشت، اثرات التهابی ناشی از امولسیفایرها را خنثی کرده و از فعالسازی ایمنی مخاطی و آسیب اپیتلیالی جلوگیری کرد.
6.3. عوامل سبک زندگی (ورزش، مدیریت استرس و خواب)
عوامل سبک زندگی نقش مهمی در سلامت روده دارند و میتوانند اثرات منفی UPFs را کاهش دهند. فعالیت بدنی منظم با افزایش تنوع میکروبی و ترویج باکتریهای تولیدکننده SCFA همراه است. ورزش همچنین عملکرد سد روده را بهبود میبخشد و التهاب سیستمیک را کاهش میدهد که میتواند برخی از اثرات مضر UPFs را معکوس کند.
مدیریت استرس یک عنصر کلیدی دیگر است، زیرا استرس مزمن میتواند از طریق محور روده-مغز میکروبیوتای روده را مختل کند. تکنیکهایی مانند ذهنآگاهی، مدیتیشن و درمان شناختی-رفتاری میتوانند به تنظیم پاسخهای استرس کمک کرده و از محیط سالم روده حمایت کنند. کیفیت و مدت زمان خواب نیز برای سلامت روده ضروری است. الگوهای خواب مختل میتوانند ترکیب میکروبی روده را تغییر داده و باعث دیسبایوز شوند. ایجاد روالهای منظم خواب و اولویتبندی بهداشت خواب میتواند به حفظ تعادل میکروبی کمک کند و استراتژیهای رژیمی و مکملی را تکمیل کند.
6.4. پیامدهای سیاستهای بهداشت عمومی
مصرف گسترده UPFs چالشهای عمدهای برای سلامت عمومی ایجاد میکند. برای مقابله با تأثیرات آنها بر سلامت روده، مداخلات سیاستی باید بر راهنماهای رژیمی، قوانین برچسبگذاری و تبلیغات مواد غذایی و مداخلات گستردهتر در محیط غذایی متمرکز شوند.
گنجاندن درجه پردازش غذا در توصیههای رژیمی برای راهنمایی مؤثر سلامت عمومی ضروری است. راهنماهای رژیمی سنتی بیشتر بر ترکیب مواد مغذی تمرکز دارند، اما اغلب تأثیر پردازش غذا بر سلامت روده را نادیده میگیرند. راهنماهای بهروزشده باید مصرف UPF را به حداقل برسانند و بر اهمیت غذاهای کامل و حداقل فرآوریشده تأکید کنند. کمپینهای آموزشی که هم متخصصان بهداشت و هم عموم مردم را هدف قرار دهند، میتوانند آگاهی از تأثیرات UPF بر سلامت روده را افزایش دهند. این کمپینها باید مزایای فیبر رژیمی، غذاهای تخمیرشده و الگوهای متنوع رژیمی را برای سلامت میکروبی برجسته کنند.
6.5. قوانین برچسبگذاری غذا و تبلیغات
برچسبگذاری شفاف و دقیق غذا ابزار قدرتمندی برای اطلاعرسانی به انتخابهای مصرفکنندگان است. برچسبهای جلوی بستهبندی (FoPLs)، مانند سیستمهای چراغ راهنمایی یا نمادهای هشدار، میتوانند بهطور مؤثر درجه پردازش و وجود افزودنیها در محصولات غذایی را منتقل کنند. سیاستگذاران باید چنین برچسبگذاری را الزامآور کنند تا به مصرفکنندگان امکان انتخاب آگاهانه داده شود. محدودیتهای تبلیغات برای UPFs، به ویژه آنهایی که به کودکان هدفگذاری شدهاند، یک حوزه کلیدی برای مداخله هستند. شواهد نشان میدهند که تبلیغات پرتبلیغ UPFs به عادات غذایی ضعیف و افزایش مصرف منجر میشود. اجرای قوانین سختگیرانهتر در مورد تبلیغات، از جمله پلتفرمهای دیجیتال و طراحی بستهبندی، میتواند به کاهش جذابیت UPFs کمک کند.
6.6. مداخلات محیط غذایی
تحول محیطهای غذایی برای اولویت دادن به گزینههای سلامتیمحور ضروری است. سیاستهای غذایی مدارس، بهویژه، میتوانند نقش مهمی در شکلدهی به عادات غذایی از سنین پایین ایفا کنند. الزام به تأمین غذاهای تازه و حداقل فرآوریشده در مدارس میتواند مصرف UPF را در میان کودکان و نوجوانان کاهش دهد. استراتژیهای برنامهریزی شهری نیز میتوانند به محیطهای غذایی سالمتر کمک کنند. برای مثال، ترویج دسترسی به محصولات تازه از طریق بازارهای کشاورزان، باغهای اجتماعی و فروشگاههای مواد غذایی مقرونبهصرفه میتواند وابستگی به UPFs را کاهش دهد. یارانهدهی به گزینههای غذایی سالم و اعمال مالیات بر UPFs ممکن است رفتار مصرفکنندگان را به سمت انتخابهای سالمتر هدایت کند.
7. نتیجهگیری
این مرور تأثیرات قابل توجه و چندوجهی UPFs بر میکروبیوم روده و پیامدهای سلامت مرتبط با آن را روشن میکند. شیرینکنندههای مصنوعی، امولسیفایرها، نگهدارندهها و افزودنیهای غذایی تعادل حساس اکوسیستم میکروبی روده را مختل میکنند، تنوع میکروبی را کاهش داده، محیط پیشالتهابی ایجاد کرده، نفوذپذیری روده
را افزایش داده و منجر به التهاب و دیسبایوز میشوند.
این تغییرات با پیامدهای منفی متابولیکی، گوارشی و روانشناختی همراه است و خطر بیماریهای مزمن، از جمله سندرم متابولیک (MetS)، بیماریهای قلبی-عروقی (CVD)، و سرطان کولورکتال را افزایش میدهد. شواهد ارائهشده نشان میدهد که کیفیت رژیم غذایی نقش حیاتی در حفظ سلامت روده دارد. گذار به رژیمی شامل غذاهای حداقل فرآوریشده و غنی از مواد مغذی میتواند اثرات مضر UPFs را کاهش دهد و تابآوری میکروبی را ترویج کند. علاوه بر این، گنجاندن پروبیوتیکها، پریبیوتیکها و تغییرات سبک زندگی استراتژیهایی بالقوه برای بازگرداندن تعادل روده ارائه میدهند.
در مقیاس وسیعتر، سیاستهای بهداشت عمومی باید به کاهش مصرف UPF از طریق آموزش، برچسبگذاری شفاف و مداخلات نظارتی اولویت دهند. تحقیقات آینده باید به تبیین مکانیسمهای پیچیده پیوند UPFs با تغییرات میکروبیوتای روده ادامه دهند و هدف از آن تدوین دستورالعملهای مبتنی بر شواهد برای شیوههای غذایی سالمتر باشد. تلاشهای جمعی در سطوح فردی، اجتماعی و سیاستی برای حفظ سلامت روده و رفاه کلی ضروری است.




